П.П.Гаряев, А.А.Кокая*, И.В.Мухина*, Е.А.Леонова-Гарясва, Н.Г.Кокая*
Инкомнаука, Москва; *Центральная научно-исследовательская лаборатория Ниже-городской государственной медицинской академии
Показано, что воздействие модулированного поджелудочной железой и селезенкой широкополосного электромагнитного излучения, генерированного гелий-неоновым лазером, на крыс с экспериментальным сахарным диабетом является информационным, феноменологическим, приводит к увеличению продолжительности жизни животных, нормализации уровня глюкозы в крови, регенерации поджелудочной железы.
Ключевые слова: аллоксановый диабет, лазерное изучение, широкополосное электромагнитное излучение
Проблема хранения и передачи управляющей генетической информации в ходе эмбрионального и постэмбрионального развития является фундаментальной. Цель работы — определение принципиальной возможности стимуляции регенера-ции поджелудочной железы (ПЖ) крыс in situ с помощью широкополосного электромагнитного излучения (ШЭИ), модулированного (через фотоны) препаратом ПЖ крыс той же линии. Для этого изучали влияние модулированного биоструктурами ШЭИ на течение экспериментального сахарного диабета (СД) у крыс Вистар.
Для получения модулированного биоструктурами ШЭИ применяли разработанную нами технологию с использованием гелий-неонового лазера. Гелий-неоновый лазер мощностью 2 МВт и длиной волны 632.8 нм имеет две совмещенные, ортогонально линейно поляризованные одночастот-ные моды излучения. Свежевыделенные препараты ПЖ или селезенки новорожденной крысы Вистар наносили на предметное стекло и помещали на оптической оси лазерного луча. Юстировку предметного стекла с препаратом производили таким образом, чтобы обеспечить частичное обратное отражение луча в резонатор лазера. Такой многопроходный режим позволяет препарату вы-ступать в роли оптического коррелятора и влиять на распределение вторичных мод излучения ла-зера. Для регистрации сигнала корреляции ис-пользовали две пространственно разнесенные моды с перпендикулярной поляризацией. Опти-ческие сигналы регистрировались и поступали на электронную схему, которая управляет режимом генерации лазера, при котором интенсивности мод наиболее скомпенсированы. В этом режиме лазер генерирует ШЭИ, зависящее от зондируе-мого биопрепарата. Расстояние от препарата до активного элемента лазера составляло 11 см. Фотоны луча лазера на встречных пучках мо-дулировались препаратом, в том числе по двум связанным ортогонально поляризованным ком-понентам излучения.
В экспериментах использовали половозрелых крыс-самцов Вистар в возрасте 5-6 мес, средней массой 180-220г. Экспериментальный СД вызыва-ли путем внутрибрюшинного введения 1.0+0.2 мл раствора аллоксана (200-300 мг/кг массы живот-ных) после 24-часового голодания на фоне норм-альных показателей уровня глюкозы в крови жи-вотных. Животных делили на 3 группы по 10 жи-вотных: 1-я группа — контроль без ШЭИ, 2-я и 3-я группы подвергались воздействию ШЭИ. В 1-й и 2-й группах аллоксан вводили в дозе 200 мг/кг, в 3-й группе — 300 MГ/КГ. Животных 2-й группы располагали на расстоянии 70 см от источника ШЭИ (лазера) 3-ю — на расстоянии 20 м от ис-точника ШЭИ в частично экранированном (подвальном) помещении лаборатории.
Обучение крыс 2-й группы начинали на 3-и сутки с момента введения аллоксана, крыс 3-й группы — в день инъекции аллоксана. Воздейст-вие ШЭИ проводили по 30 мин ежедневно в течение 4 дней по схеме 10 мин воздействие ШЭИ, полученным в результате прохождения лазерного луча через препарат с тканью ПЖ 10 мин воздействие ШЭИ полученным в результатс прохождения лазерного луча через препарат с тканью се-лезенки; 10 мин воздействие ШЭИ, полученным в результате прохождения лазерного луча через препарат с тканью ПЖ.
Во вpемя эксперимента оценивали общее состояние животных, фиксировали день гибели животных с момента введения аллоксана во всех наблюдаемьгх группах. Животных в опытных группах наблюдали в течение 1.5 мес с момента введения аллоксана. У 5 крыс с максимальным подъемом уровня глюкозы в крови после введения ал-локсана оценивали репродуктивную функцию (3 крысы из 2-й группы и 2 крысы из 3-й группы). Уровень глюкозы в крови регистрировали глю-кометром Ascensia Entrust” (“Bayer”) в диапазоне 2.0-30.6 ммоль/л.
Ткани сердца, легких, печени, почек, селезен ки и ПЖ забирали для макроскопического описания и гистологического исследования: в контрольной группе — на 3-и сутки с момента введения аллоксана, что соответствовало дню максимальной гибели животных; во 2-й и 3-й группах — через 1 сут после последнего дня воздействия ШЭИ, что соответствовало 7-м суткам с момента введения аллоксана во 2-й группе и 4-м суткам в 3-й группе; а также на 42-е сутки эксперимента у выживших животных. Для гистологического исследования ткани фиксировали в 10% нейтральном формалине, обезвоживали в спиртах восходящей концентрации и заливали в парафин Парафиновые срезы толщиной 5-7 мкм получали на микротоме ‘Leica SM 2000R”, окрашивали ге-матоксилином и эозином и анализировали с помощью микроскопа “Leica DMLS”. Видеоизображения получали на видеосистеме с помощью CCD-камеры.
Применение субтоксических доз аллоксана в контрольной группе способствовало развитию СД, осложненного токсическим повреждением ряда жизненно важных органов и систем что приво-дило к высокой летальности (70%) уже на 3-и сутки (рис. 1). Уровень глюкозы в крови за период наблюдения самопроизвольно не снижался.
ШЭИ отчетливо влияло на течение экспериментального аллоксанового СД во 2-й группе. На 3-и сутки приходился пик уровня глюкозы (25.21 ± 1.03 моль/л) достоверно (р<0.05) отличающийся от исходного уровня (5.70±0.30 моль/л). На 7 е сутки уровень глюкозы достоверно (р<0.05 по отношению к данным до ШЭИ) снижался до 6.75±0.60 моль/л. После воздействия ШЭИ уровень глюкозы в крови достоверно снижался у 80% животных 20% животных умерли на фоне выраженной гипергликемии на 6-7-е сутки после введения аллоксана, что отличается от контроль-ной группы (рис. 1). Через 1 сут после последне-го воздействия ШЭИ т.е. на 7-е сутки экспери-мента уровень глюкозы в крови был в пределах физиологической нормы (5.56+0.12 ммоль/л) у 3 крыс.
Пять выживших крыс наблюдали в течение 1.5 мес. У 3 из них оценили репродуктивную функцию. Одна крыса не дала потомства и умерла на 40-е сутки после введения аллоксана, что весьма существенно отличается от контрольной группы (рис. 1). Две другие крысы дали полноценное потомство 14 и 11 крысят. Через 1.5 мес после введения аллоксана у оставшихся в живых
4 крыс были изъяты ткани для патоморфологического исследования Уровень глюкозы в крови у
этих животных составил менее 10 ммоль/л.ШЭИ влияло на течение экспериментального аллоксанового СД у крыс 3-й группы.
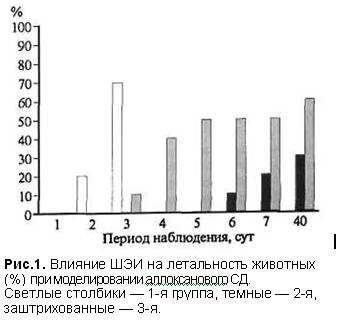
Уровень летальности, однако, отличался от данных 2-й и контрольной rpупп (рис.1). Несмотря на большую дозу введенного аллоксана для животных этой rруппы характерно увеличение продолжительно-сти жизни по сравнению с контролем. Смертность в 3-й группе на 4 е сутки с момента введения аллоксана составляла 50% по сравнению с контро-лем. У 2 крыс 3-й группы в течение длительного периода наблюдения (1.5 мес) отмечалось колеба-ние уровня глюкозы в крови от нормальных до максимальных значений (>30.6 ммоль/л). Ана-логичную картину наблюдали у 1 крысы во 2-й группе. Несмотря на явную гипергликемию в те-чение, всего периода наблюдения, общее состоя-ние этих животных расценивали как удовлетво-рительное, они были активны и прожили 40 сут с момента введения аллоксана. Через 1 сут после последнего воздействия ШЭИ, т.е. на 4-е сутки, провели эвтаназию 2 животных и изъяли ткани для патморфологического исследования. За ос-тавшимися животными (3 крысы) наблюдали в течение 1.5 мес. У 2 из них оценивали репро-дуктивную функцию, которая был снижена.
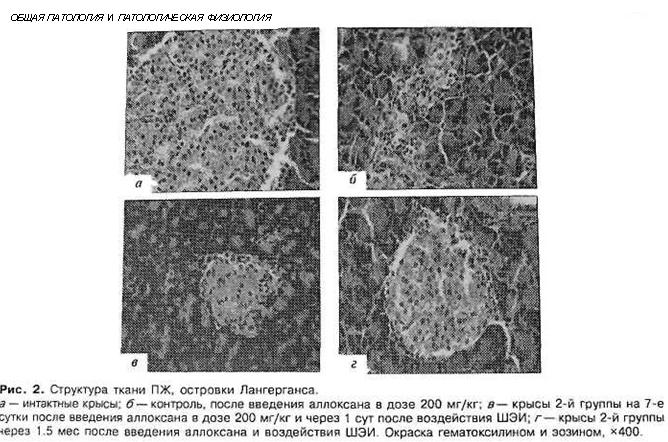
При гистологическом исследовании препа-ратов ПЖ выявлен ряд особенностей (рис. 2). У животных с аллоксановым СД выявлены выра-женные дегенеративные изменения островков Лан-герганса (рис. 2. б). Число и размер островков уменьшены. Форма их неправильная. Количество β-клеток в островках резко снижено, в большин-стве из них отмечена вакуолизация цитоплазмы, уменьшение размеров ядер, конденсация хрома-тина в некоторых клетках — кариопикноз. Вы-явлено наличие лимфоцитарного инфильтрата вокруг и внутри части островков. Гистологичес-кая картина препаратов ПЖ крыс 2-й группы на 7-е сутки с момента введения аллоксана отли-чалась признаками функционального напряжения работы островка в отличие от препаратов конт-рольной группы. Ядра в основном были не по-вреждены (рис. 2, в). Наличие большого коли-чества мелких островков правильной формы и нормальной гистологической структуры вблизи кровеносных синусов и протоков спустя 1.5 мес с момента введения аллоксана возможно сви детельствует об активации регенерационных процессов в ПЖ (рис. 2, г).
В данном акте, возможно, задействованы принципы квантовой нелокальности (спутаннос-ти) морфогенетическои информации связанной с поляризационной (спиновой) модуляцией фо-тонов лазерного луча и с последующим преобра-зованием фотонов в ШЭИ [1,2]. В определенной мере это подтверждается недавними результа-тами по успешному “введению информации” (свойств) различных веществ непосредственно в головной мозг испытуемых людей с помощью спутанных спиновых состояний [3]. Чтобы создать “спутанные состояния” между спинами ядер ато-мов действующих веществ (морфин, хлороформ, дейтерохлороформ, диэтиловый спирт, никотин, кофеин н др.) и спинами ядер вещества головно-го мозга использовали импульсное магнитное по-ле, фотовспышку, СВЧ-излученис и красный ла-зерный свет [3].
ЛИТЕРАТУРА
1. Прангишвили И. В. , Гаряев П.П. Тертышный Г.Г. и др.
//Датчики и системы. 2000. №9. С. 2-13.
2. Gariaev Р.Р. Birshtein В.I., Jarochenko A.M. et al //Int.
J. Comp. Anticipat. Systems. 2001. Vol. 10. P. 290-310.
3. HuH., Wu M. // Progr. Physics. 2006. Vol. 3. P. 20-26.
Бюллетень экспериментальной биологии и медицины, 2007, Том 143, № 2